|
Молекулярно-динамическое моделирование белков родопсина и преонов:
влияние замещения аминокислот, связанного с возникновением заболеваний,
на динамику и конформационные изменения
Холмуродов Х. Т.
Молекулярно-динамическое (МД) моделирование выполнено с целью исследования
структурных конформаций белков родопсина и преонов. Исследованo влияние замещения аминокислот,
связанного с возникновением заболеваний, на динамику и конформационные изменения белков.
Для белка родопсина (Rh) выполнены 3-нс МД-вычисления и представлены
данные структурных анализов для "темного состояния" Rh.
Значения RMSD (среднеквадратичные отклонения) оценены для отдельных
структурных спиралей I-VII белка Rh.
Анализ и сравнение вычислительных данных RMSD показывают
внутримолекулярные относительные смещения спиралей Rh,
которые не сходны друг с другом.
Спирали I, III и V показывают наибольшие отклонения от исходных структур.
Картинки (snapshots) структурных данных строились и сравнивались для
исходной и конечной конфигураций. Результаты показывают наибольшие отклонения от исходных положений для спиралей III и V в структуре белка Rh.
Эти наибольшие отклонения спиралей отчетливо прослеживаются
в цитоплазмическом домене белка; внешняя (extracellular) часть Rh
показывает относительно слабое смещение. Было также оценено влияние аминокислотного (мутационного) E134N-замещения на динамику конформационных изменений Rh.
Вышеназванное E134N-замещение рассматривается с точки зрения экспериментального изучения как один из главных факторов в механизме функционирования белка Rh. Анализ полученных вычислительных данных и их сравнение указывают на сходность конформационных свойств нормального Rh и белка с E134N-замещением. МД-моделирование также проводилось над тремя моделями человеческого белка преона (human PrP). Оценено влияние болезнетворных мутантов (аминокислотных замещений), связанное с возникновением заболевания Крейцфельдта--Якоба, на динамику и конформационныe изменения PrP.
Обнаружено частичное разрушение структуры белка PrP как следствие аминокислотного
Glu200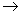 Lys-замещения,
и представлен механизм данного процесса (структурной неустойчивости) на молекулярном уровне. Lys-замещения,
и представлен механизм данного процесса (структурной неустойчивости) на молекулярном уровне.
PDF
(1.38 Mb)
|
